电负性在哪本书里面
ok, 高二学结构化学的同学们,我们这个视频来讲一下垫付性和对角线的一些规则,然后整个两个小知识点呢,都比较基础啊,也比较简单。这个我最近在想一个问题啊,因为我看这个选秀三的这个点赞率会稍微低一点啊, 是大家觉得没学到呢,还是说这个比较简单呢啊,这个很好奇啊,你可以在咱们这个粉丝群里面啊,高二这个粉丝群里面发一下, 或者是你点点赞,是吧,咱就了解了啊,哈哈,行,我们来讲一下这个垫付信啊,整体来说确实比较简单。垫付信是什么?一般我喜欢啊,就是刚开始给大家去理解垫付信,很多人听了这个新的名词过后,我喜欢叫它付电信, 是吧?负电性,把它理解为这个负啥意思啊?就是吸附电子的这个能力,对不对?你就懂了,就相当于吸附电子能力,负电性是吧?电负 信啊,没事,你把它理解到了,就是啥意思?不同原子对剑和电子的吸引力的大小,就是你得电子能力越强,你的电复性越强,所以这块需要一点必修二啊,当然,哎,就是高一我们学过这个元素周期表这块的规律,就是非净性最强的。那就是服了, 因为浮在周期表当中得电能力最强,他一般是四点零啊,后面咱们好像改成三点九八了。这个都无所谓,反正他就是最猛的,全部都以他为相对标准,他就是标杆啊,你看所有人都朝向这边望是吧?啊?神秘的东方,我朝你向朝,朝你这边望,对不对啊?他最猛,那你就知道了,其实这个基本规律你就会了, 那你垫付性一般是吧?金属元素的垫付性要较小,非金属垫付性较大,那就得电子能力嘛。那肯定是这样的。然后在这种,你看这个周期表稍微有点印象,很多老师喜欢叫一点八规则是吧? 在这个周周边是吧?规者心这一块,你看他垫幅心在一点八左右啊,在这个就是咱们之前讲的金属区和非金属区的交界处,是不是啊?这一块 对不对啊?好像是这样,然后呢,他们是既有金属性又非金属性啊,这无所谓,你了解一下同主族,其实咱们探究的比较少,更多的就是你反应,记住,越靠近服,他的垫付性越强啊。所以这个同周期你就理解为非金属性就行了啊。 说来说去,反正就是第一个应用就在这了,垫付性越大的,非进入性越强,金属性越弱,这个就是,呃,全国卷里面考的最多的就是送分的, 一般给了你三四种元素,让你去比较一些垫付性大小,越靠近幅度越大,没有特例啊,就行了。你说老师那同事一一点八的怎么比较呢?你就他不会考你的好吗?行。然后第二个这一块小小的重点啊,叫做判断化还建立。 那我们知道越靠近扶的垫腹性越大,那他越容易得垫子,那他的值肯定就越大,那就越远离扶的值就越小,他就越容易失垫子。 所以我们有个叫一点七规则,如果两种成见原子的垫腹性差值,就是你差的太大了,大于一点七,我们就容易形成离子键,因为离子键不是阴阳离子干的事对不对?所以啊,一般大于一点七就容易形成离子键。这个我在模拟题见过啊,这个大家有点印象吧, 如果小一点气就比较形成共价键啊,你看看上面差距比较小的他都不愿意湿,大家一块用呗就共价呗,对不对啊。第二章好好来讲一下共价键, 然后你再看第三个,第三个我一般老爱喜欢问的就是你当高一学过这个非进入性,越靠近福越强,我们都知道那养和绿怎么比较呀,是不是很多老师那福比养大,那福也比绿大,那养和绿还是没法比较, 那羊比刘大,绿也比刘大,那羊和绿还是没必要比较,怎么办呢?所以这个地方有一个小小的经验啊,就是看这 就可以在化合物当中看他的架态。那那就是垫负性大的表现。副驾呗,你比如说像这个二氧化率这一般常见的消毒剂嘛,是吧。常氧化剂 这玩意正四,这玩意负二,你看痒和绿在一块,他俩就开始我俩弯弯,是不是我俩白头。那痒把绿的垫子给怎么样?得了得了,先副驾吗,那痒把绿的垫子得了。那就养大于绿嘛。 电复信啊,那还有人?你查你查百度能把你气死是吧。那怎么判断还是看电复信表。因为养是三点五,律是三点零,所以养大一律,这不是气死个人吗对不对?哈哈哈。所以,呃,给大家教一个这方法,其实这方法用的还挺多,尤其是高三的以后的题啊,好不好。这就是电复信的一块知识点啊,倒不难,很简单啊。一, 一定要理解飞行顺序,如果你飞行顺有有问题啊,你学习这块有点别扭好不好?行,那还有个叫对角性规则,这几年也是一九年,二零年吧,还是二零二一年,反正全国卷里面的 对对角线的考察就是贼弱智。什么叫对角线啊?就是在元素周期表当中,某些主族元素以他的右下方主族元素的颠覆性接近,性质相似啊,性质相似,所以被称对角线规则。就这三对嘛, 里皮棚对应的美铝硅啊,这个在周期表中很好找啊,所以这个高考题考过了就这么简单,因为铝与理性质相似的零足元素是谁?那就是美呗, 对不对?与彭相似的零组元素是谁?就是归呗,这都是考过的好吗?那其实我们以前最爱今年考的就是吕,是不是?这下面的实力分析你自己看一下吧,你比如说吕, 其实咱们都知道啊,高于学过铝的事也太多了,他这一家子都都事都挺多的,事事的是吧?就是铝啊,氧化铝,氢氧化铝既可以和酸反,又可以和碱反,那皮也可以, 是不是那铝的好的性质那皮也可以,是不是啊?你行我也行啊,很多性质相似,所以就总结出来这么一个叫对角线规则啊,大家把这三对记住,一般其实就够用了,再记住他们性质相似,你只要知道一个,其实另一个也就出来了好吗?这个就是咱们今天讲的垫付性和对角线规则,特别基础,一定要没有问题。
粉丝6.0万获赞33.6万
相关视频
 02:45查看AI文稿AI文稿
02:45查看AI文稿AI文稿正常书上叫啥呢叫吸引电能力说听不懂啊啊不听啊你就看这个行了啊来这边讲啥电复性对,电复性是不是电复性。嗯怎么比呢就这样啊,就是什么叫电复性显什么价附加。对就这意思,也就是他越显附加的颠覆性越准呢。 月月啊大哎明白吗?哎是不是所以就是显副驾能力是不是 啊正常书上叫啥呢叫吸引电子能力是不听不懂啊啊不听好啊你就看这个行了啊电复性是不是显副驾能力是不是啊别写副驾,我数学大。 嗯对吧。那你看啊他有一个大概的规律吧是不是比如说咱这圆周围表是不是长这样咱就讲这个事是吧。嗯越往哪边分阴属性就大,非金属性右边 右边右上是不是。嗯就这一揪这块呢是不是接触性越大所以记住垫付性跟非主性的规律是一样一样的啊哎所以有哪一个右上谁最狠 嗨哎但是还有副驾没。没有没有,谁把西游记给扣掉剩谁了。 掐指一算哦啥哪没有西游记里还他妈说西游记里扫庆亥里皮棚汉代汉养福乃福哦最最大的就是福是不是啊先告诉我福有正价没。 没有,为啥因为他最大完事了。哦哎明白了是不是最大这不是起吗不你指的是那个钻石电影术吗啊 啊这就是一个特殊的性质。哦明白吧。那我问你啊你说福前面是谁。青海里不是青啊。青海李玉峰看淡羊奶,青海李玉鹏看淡养福奶吧。福底下谁 是不比不了吗。对呀老师比不了啊你瞅着啊是不是垫付性?是不是啊,你把他俩拽在同一个画屋里,你看谁写副驾驶就大就完事了呗。哦,举个例子来,哪个屋子里面有绿培养 啊?吃驴。吃驴是吧?可以怎么写?收 sl 啊?清多少价?清赠一价。对,养多少价 负二价。所以绿多少价负一价啊。赠一价。哎。赠一价是不?谁先付价。 痒。哎。谁谁的啊?痒吧。不要了。哦,明白了。我成奸大了。明白了。
3288化学李 03:27查看AI文稿AI文稿
03:27查看AI文稿AI文稿好,今天给大家说一下结构化学中半径比较,电低能和电附性的一些知识点。我们现在第一个半径比较啊,半径比较,其实大部分同学呢,都是有自己的一套方法呢,那我说的这种方法呢,会是一个比较完整,比较程序化的一个流程,它是针对于原子和离子都是通用的。 我们的第一步先比较和外电子层数,层数越多他就越大。但是呢,有一个例外啊,就是里要比绿要大的,里只有两层,绿有三层,但我们的里原子依旧是比绿原子要大。由于高中只有这么一个例外,大家特殊记一下就行了。 好,如果电子从数是相同的,我们就往下看。第二步再去比较质子数,质子数越多,他反而越响啊,因为质子数越多,原子核对于 和外电子的束缚力就会越大,那么他会使外层的电子收缩,使其半径变小。好,那如果质子数也相同怎么办?那我们就比较和外电子数, 和外电子数越多,他就越大。那这种情况其实只会出现于同元素原子和离子之间的比较。比如说我们的绿原子和绿离子啊,他俩的质子数是一样的,但是他俩的和外电子数不一样, 这个数一样,说明他们的束缚力总量是一样的,但是这个束缚力要均匀的分散到盒外的每一个电子上, 那么盒外的电子越多,他能分散到的束缚力就会越小,那么对应的他的半径就会越大啊,就是通过这个理论我们去给他比较出来的。好,下面我们看一下电离能、 电力能,我们主要要注意一下他的一个交错现象,正常情况下同周期电力能从左向右是依次增大的,但是二三五六是有一个交错现象, 他是因为第二主足有一个全充满,第五主足有一个半充满,那么全充满半充满是比较稳定的状态,失去电子的话,消耗的能量相对来讲要多一些啊,因此出现一个交错现象。 第二个就是电离能最大的是亥啊,不是福,那亥呢?他是有两个优点,第一个离合近,第二个 全充满,这两个优势才成就他电力能最大的一个身份啊。我们下边再看一下垫付性啊。垫付性首先第一点他是判断元素性质的主要依据啊,不管是还原性、氧化性 还是给他进行金属和非金属分类的时候,我们大部分时候都是依据垫付性来的。呃,比如说我们垫付性最大的是福,所以说我们氧化性最强的呢,就是负担制啊,我们垫付性最小的是涩,所以说还原性最强的金属呢就是涩 啊。然后就是垫付性和电力能的比较呢,就是垫付性,他也是同周期从左向右依次增大的,但是啊,垫付性没有交错现象, 比如说我们电力能,但呢是大于养的,但是垫附性呢,但呢就依旧是小于养的 啊。那么最后氧化性我们是听电离能的还是听垫付性的呢啊?答案是听垫付性的 氧化性,但是小鱼养的啊,对照了我们前面说的第一句话,电速性是判断元素性质的主要依据啊,那么电离能的话作为次要参考即可。
681天津教育@化学刘老师 08:28查看AI文稿AI文稿
08:28查看AI文稿AI文稿第四讲电离能。大家好,今天分享的是高中化学选修二第一章第二节原子结构与元素周期率的内容,点赞收藏加关注,网址需要的时候找不到。 那么今天呢,咱们重点分享啊,第一个高频考点,在这一节当中呢,第一个高频考点就是电离能,他的含义和应用。第二个考点呢,是我们下节课要分享的关于垫负性的内容, 那么电离能呢?从某种医生讲,我们可以把它想象成什么呢?想象成一种还原性,因为电离能说的是怎么回事呢?就是电子脱离原子的一个什么?所需要的一个能量, 电子是否容易脱离这个原子?和咱们之前说还原性容不容易实习电子是不是意味着是,但是呢他又有所缺。 区别什么区别呢?就是之前的还原性,可能是失去一个电子,也可能是失去多个电子啊,反正是失去什么最外层电子数啊,这是一个什么?失去电子一个最高的一个数量。而电力能呢,它又分为什么叫第一电力能,第二电力能,第三电力能。 什么叫第一电子能?就是原子他失去第一个电子需要的能量,那如果他失去了这个电子,在失去第二个电子的时候,那么那个电子所需要的能量就称之为什么第二电力能啊, 这是定义。那么我怎么应用他,或者说考试的时候又想考我的话,他会考些什么内容呢?这里面我们首先说第一个内容,就是电力能的一个应用,最常见的一个应用啊,这样的一个应用我们看一下,举个例子啊,比如说以屡元素为例, 老师随便写哈,他这个电力能,老师数据没查哈,大概意思就比如说第一个电子很容易失去,你中间质子数是十三,对吧?你外面是二八三,那我们说你这三个电子当中,对吧?你很容易失去一个电子,对不对啊?失去一个电子的话,它的能量,比如说是三百啊, 那如果你失去一个电子,这个变成二啊,然后的话,失去第二个电子可能变成多少?比如说四百啊,失去第三个电子是多少呢?可能是五百啊,是这样的, 那我想你把三个电子失去了,当你失去第四个电子的时候,是不是就要从他稳定的第二层八电子的这个里面失去了,对吧? 那这个时候可能他失去第四个电子,他就需要的能量变成了什么?两千五啊?为什么前面这三个能量特别小,后面这个第四个能量就特别大了呢?需求 给电子的一个能量啊,因为很简单,就是前面那三个是一个什么,没有这个填充满,他是可失去的电子啊,他就非常容易啊。然后的话,这两千五相当于是什么已经稳定了, 你从一个稳定结构当中去扣扣东西,这就很难啊。就再举一个不算特别恰当的一个例子,就好像什么呢?就好像这个,我们说跑在马路上的这个汽车,对吧? 汽车的话呢?表面都有什么?都涂有这个汽车的这个油漆,对吧?油漆上在下雨快天的时候怎么样?他容易粘上一些什么泥土啊?产生一些脏东西。 那我们在擦车的时候容不容易啊?非常容易就可以把表面的那些脏东西,什么泥巴呀、灰尘呐擦掉,但是我们想你用抹布使劲用力的擦,能不能把车漆擦掉,这是不可能的。但是如果, 如果今天换成一个什么,那个钢丝绒球就把使劲子一蹭,也是能擦掉的,说明一个什么问题?就是他电子吸附原子盒牢不牢啊?如果他是一个牢固的状态,你把他脱落,脱落掉啊,想把它拿掉就会很困难啊,就这么一个东西, 那我们的一个第一个应用就是什么通过题目当中给他电力能啊,比如说他有给了什么四个电力能,五个电力能,哎,我就知道他最外层这个未知元素,最外层电子数, 对吧?啊?我们再举一个例子,不知道这是哪个元素,老师随便写一个啊?比如说有一个元素他叫 x, 这个 x 元素当中他的一个电力能,第一电力能是多少呢?五百 啊,第二天利能多少?六百,然后第三天利能多少?一千七,第四天利能可能是妈两千一。好了, 我们能得到什么信息?这个 x 元素最爱层电子数应该是多少?应该是两个,因为他从第三个开始他怎么样,他就突然变大了,说明什么?第三个他特别的牢固啊。 好,这里面咱们就解释清楚了。这个啊,这是第一个考点,那么第二个考点偶尔会涉及到的一个信息是什么呢?我们来看这幅图片, 这是常见的啊,主足元素当中他第一电力能的一个变化啊,那我们这里会发现他有一个什么特点呢? 他应该是一个什么?就是之前咱们说的有点还原性那个意思啊?清在这还在这,那为什么清失去一个电子比还失去一个电子要,呃,怎么说呢?要这个能量少呢?因为清啊,质子数是多少?正一还是多少?正二,正二肯定比正一吸引电 电子的能力强,对吧?这好理解,理和皮也是一样,但是棚这就出意外了,我们知道棚是多少,棚是五号元素,他有五个质子,而皮有四个质子,正四,那按理来说这个正五吸引电子能力应该是比正四要强的,但是相反我们看到了一个事, 皮失去电子照比棚怎么样要困难,按理来说他应该更容易一些,怎么能困难呢?这个就与咱们之前说的什么说的那个红特规则有关系啊。我们这里简单画一下这个皮和棚,他的电子排布室 皮是多少?正四正四加,对吧?这不是正四加,皮,这里面皮是质子数多少?正四,对吧?四个字字,然后横的话五个字字怎么画呢?一 s 二,然后的话呢?二 s 二没事了,四个电子,这是五个电子,那就一 s 二,二 s 二,然后呢?二 p 一。 好了,那话这个我们会发现这里面你比如说你这个棚,他就想失去电子,那首先失去的是什么?最外圈能量最高的这个电子很容易失去,对吧?失去了就行了,非常容易。 那我们看一下皮容不容易失去,虽然说他的吸引电子能力没有这个正五强,他只有正四,但是你要想让他脱离一个电子,他必须怎么样破坏自己这个稳定结构? 他最外层是两个电子没错,但是这两个电子达到了 s 轨道的一个全满状态,特别稳定啊,就相当于你跟你的同桌,对吧?非常友好的在一起,对吧? 在跳着舞啊,突然有人要把你们俩拆开,这个就怎么样就会困难一些,不像这个家伙,这个家伙呢,在失去的时候,虽然说这个,我们说这个棚对吧?虽然形成三个电子,但是有两个,怎么样?他成对了啊?成对,在在在,我们说绕口运动,他比较稳定, 而你这是属于多余的,他就很容易,怎么样就脱离开了,这个怎么样就不容易,也就是说你当你破坏了什么红特规则当中指出的 全空拌满,全满的时候,耗费的能量就会比正常的怎么样能量会多,那么这里面皮和棚是这样的, 那么还有谁呢?我们还能看到皮,除了皮和棚是这样的,氧和蛋也是会出现这个异常,氧和蛋出现的异常的原因,我们同样用这个电子轨道排骨式 来解释一下,但和氧,但是七号,这个氧是多少?八号,那么这个写起来就是一 s 二二 s 二,然后呢?二 p 三,一 s 二二 s 二二 p 四,那这个时候我们就能看到这个 p 轨道, 他有三个轨道,每个轨道占一个电子,对吧?三个电子刚好达到一个半充满状态比较稳定,而你养这块呢,不是半充满,也不是全满,也不是全空,所以呢破坏起来就比什么这个 p 三啊,我们说 p 轨道半本状态就要容易的多,因此你容易的多,耗费能量就少, 所以我们能看到啊,在这个第一电力能这他就呈现一个特殊的一个变化规律啊,这里面注意好这点就可以了。好,这一刻内容咱们就分享到这,有任何关于电力能的问题,欢迎随时和老师评论区互动,拜拜。
1034范老师的化学自习室 01:01
01:01 07:00查看AI文稿AI文稿
07:00查看AI文稿AI文稿各位同学大家好,这节我们介绍原子结构和元素性质,主要讲解电力能和电负性。 所谓电力能,是指气态的中型原子失去电子所需要吸收的最小能量。那么当气态原子失去他的第一个电子吸收的最小能量,我们称之为叫第一电力能。 电力能的符号用啊,来表示那第一电力能就用啊,一来表示那当他再失去一个电子吸收的能量,就叫他第二电力能用啊,二来表示他们的单位都是千娇美魔。 对于一个原子来说,它外层有多少电子,那理论上它就最多可以有多少电力能。而电力能之间的关系是一 增大的。例如 m 这个原子失去一个电子变成 m 正离子,此时吸收能量叫第一电力能,再失去一个电子变成 m 二正离子 吸收的能量叫第二电离能,再失去一个变成 m 三正阳离子吸收的能量叫第三电离能。由于 m 正离子已经想得电子, 这时候再让他失去一个电子变成 m 二正就显得更困难一些,所需要吸收的能量就更大一些。所以啊,二要大于啊,一 不难推出二三要大于二二,所以二一二二二三之间的关系是一尺增大的。 观察元素周期表同一周期电离能的数据,以第三周期为例,纳美、铝、归零、硫、氯, 他们的第一电力能数据是在依次增大的。可是中间我们也发现一些反常的数据,例如美,他的第一电力能比铝要大,零他的第一电力能比流还要大。这是因为 美和零他们的假电子排布处于全满或半满的结构,所以对于美和零而言,他们处于相对稳定的状态。失去一个电子所需要的能量要偏高一些,电力能也会反常偏大一些。 那么我们得出了同周期从左到右电力能在增加,但是各 别会出现反常,主要有皮、氮、镁、磷四个元素,确切的说是第二组组元素和第五组组元素在电力能上会出现反常增加的现象。 观察同组组从上到下电力能的变化情况,但 族元素同主族从上到下电力能再依次减小,这是因为随着原子半径的增大,是电子能力逐渐增强,失去一个电子吸收的能量越小,电力能就越来越小。 我们只要能总结同组组从上到下电力能的变化趋势是依次减小的。 观察 电力能随着原子序数的数据可以看出元素周期表中电力能的变化数据呈现周期性的变化趋势。同周期 电力能的趋势是在逐渐增加的,但也会出现一些反常。像我们所提到的皮、蛋、镁、磷、儿童组足从上到下的电力能是在降低的,看氢里钠、钾的关系,所以我们不难得出结论。 电力能与飞机属性的变化趋势比较相似,从左到右电力能增大,从上到下电力能减小,但是个别会在第二组组和第五组组出现电力能的反常现象。 电复性的概念所谓电复性是指元素在化合物中吸引电子的能力,电复性是一个相对的值,他没有单位 吸引能力最强的元素是氟,非金属性最强的元素也是氟,那垫付性最大的元素就是氟。我们以氟的垫付性为四点零为标准,其他元素的垫付性以他为参考,都会小于四点零。 通过观察周期表中垫付性的数据,发现,从左到右,垫付性意思增大,从上往下,垫付性逐渐减小。 电复性的数据几乎和元素非金属性的变化趋势是一致的。 垫付性的作用垫付性可以判断元素的非金属性,一般来说,垫付性越大,非金属性就越强。 垫付性的差值 data x 还可以用来判断化合物中的化学件的情况。两个元素垫付性的差异称之为 data x。 如果 data x 大于一点七,说明 得失电子能力差异比较大,两者之间形成的是离子结。如果 detax 的差值 detax 小于一点七,那 得电子能力差异不大,则形成共加减。对角线规则也可以用垫付性去衡量。礼和美 皮和铝,他们的垫付性数值相近,所以铝和镁,皮和铝具有相似的性质,这就是对角线规则。 例题,例一下列按原子半径减小电力能增加的顺序排列,正确的是 a 项,因为 b 项的美、 c 项的氮和 d 项的磷都会由于 反常情况造成第一电力能会反常增大。第二题说法正确的选择地下 a 项。第三周期元素中纳的第一电力能是最小的。 b 项由于美电力能反常,美的电力能比铝的第一电力能要大。 b 项错误。 c 项 所有元素中氟的第一电力能不是最大的,第一电力能最大的是稀有气体。地上是正确的,氟的垫付性是最大的。这节课我们就上到这里,谢谢大家。
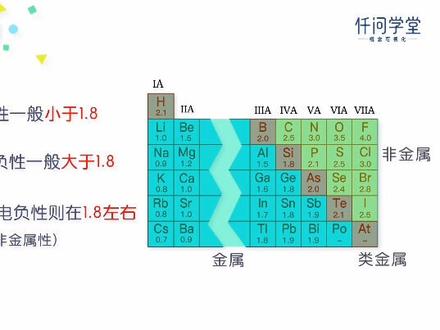 02:31查看AI文稿AI文稿
02:31查看AI文稿AI文稿电离能是用来衡量原子失电子能力的,那原子的得电子能力用什么来衡量呢?我们用电负性来衡量。 在化合物中,原子用于形成化学件的电子称为件合电子。电附性是用来描述不同元素的原子对件合电子吸引力的大小。 科学家报龄利用实验数据进行了理论计算,以伏的电负性为四点零作为相对标准,得出了个元素的电负性。 一般来说,周期表从左往右,元素的垫付性逐渐变大,从上到下,元素的垫付性逐渐变小。这个规律和元素的非金属性 变化规律是一致的。从周期表中的垫付性数据来看,我们发现金属的垫付性一般是小于一点八的,非金属的垫付性一般是大于一点八的。 而位于非金属和金属边界的类金属的颠覆性则在一点八左右,他们既有金属性,又有非金属性。 电负性的大小也可以用于化合物中元素化合价的判断。比如钠的电负性为零点九,轻的电负性为二点一, 说明氢的得电的能力比较强,所以氢化钠中氢元素为负价肽,钠元素为正价肽。颠覆性不仅可以判断化合价,还能帮助我们 化合物中的化学件到底是贡家件还是离子件。一般来说,成件元素原子的颠覆性的差值超过一点七的时候,形成的是离子件, 而沉淀元素原子的电负性差值小于一点七的时候,形成共加件。比如氧化钠中氧的电负性为三点五,钠为零点九,差值是二点六,大于一点七,所以氧化钠中形成的是离子键。 当然这只是一般规律,也有一些化合物不遵循这个规律,比如氟化氢就是一个特例。氢和氟的电附性差值为一点九,但是形成的却是供价件,这个需要大家特别注意了。
303化学杜杜老师来了
猜你喜欢
最新视频
- 2407冬哥化学











