青夏教育:分子间的作用力的定义.
粉丝7.6万获赞48.3万
相关视频
 02:19
02:19 08:12查看AI文稿AI文稿
08:12查看AI文稿AI文稿护理大师,同学们,好,这就我们来学习分子间的作用力。 通过上个视频的学习,我们知道了常见的物质是由大量分子、原子构成的,分子之间存在间隙,并且还在不停的做无规则运动。 那既然分子间有间隙,又在永不停息的做无规则运动,为什么我们通常看到的物体不会分散开来呢? 是什么力量让这些分子聚合在一起,从而使物体保持一定的形状或体积呢?这是因为分子之间存在隐。 下面物理大师就带领同学们来观察一个小实验,验证这个观点。这里有两个签注, 我们将两个签注的底面削平削干净,然后紧紧的压在一起,会发现这两个签注会结合在一起,即使用力拉也不会掉下来。 这个现象就说明了牵住的分子之间存在着引力。当然生活中分子之间存在引力的例子还有很多,比如我们看到草叶上的露珠,它的形状接近一坨球形, 很多物体具有一定的形状,而不是一盘散沙,铁棒难以被拉断等等,这些都是分子引力的具体体现。 好,既然分子之间存在引力,那为什么分子却不会紧紧的靠在一起,而是相互之间存在一定间隙呢?这是因为分子之间除了有引力以外,同样还存在着势力。 比如我们在压缩气体的时候,一开始会觉得比较容易压缩,这是因为气体分子间的间隙比较大, 一旦当气体压缩到一定体积时,想继续压缩下去就会变得很难,说明分子之间存在对外的力,抵抗着外界的挤压,这就是分子之间存在势力的表现。 需要同学们注意的是,虽然分子之间有时表现出引力,有时表现出 势力,但分子之间的盈利和势力是时时刻刻同时存在的,这个是本结构的重点。 讲到这里,同学们可能就很疑惑了,既然时时刻刻同时存在,那为什么一会表现出引力,一会又表现吃力呢? 首先,在大多数情况下,构成物质的分子一般处于一个稳定的状态,此时分子间的距离等于平衡距离。 当分子间距离为平衡距离时,分子间的引力会等于吃力。 分子间不表现出力的作用,但同学们要注意,虽然他们之间不表现出力的作用, 但引力和赤力还是同时存在的。当物体被压缩时,此时分子间的距离小于平衡距离,那么这个时候他们之间的赤力就会大于引力,所以最终表现出来的就是赤力。 而当物体被拉伸时,分子间的距离大于平衡距离。引力大于吃力,分子之间则表现出引力。 这里需要同学们注意,如果分子间的距离继续增大,大于十倍的平衡距离时,分子间的引力和吃力都变得非常微弱,可以看作没有相互作用力。最后,物理大师还 还是要强调一下本节的重点,无论分子监视最终表现是引力还是赤力,分子之间的引力和赤力是时时刻刻同时存在的。 现在物理大师问同学们一个问题啊,为什么破碎的玻璃,即使我们把它们压在一起都无法复原?这是因为分子精的作用力表现为吃力吗? 这个问题非常具有迷惑性,需要注意啊!分子间的作用力只有在分子之间的距离很小时才能体现出来, 而破碎处的玻璃就算是被紧紧压在一起,他们分子之间的距离还是太大, 几乎没有作用力,不能复原。所以不能复原的原因是玻璃破碎处的分子之间的间距太大,导致作用力太小。 好,通过以上的学习,我们就得到了分子动理论的全部内容。一、常见的物质都是由大量的分子原子构成的。 二、分子之间存在着间隙。三、分子在永不停息的做无规则运动。四、分子之间总是同时存在着引力和智力。 分子动力令的内容是本章的重点,需要同学们理解并牢记。 下面我们通过例题来巩固一下关于下列现象说法,正确的是同学们可以先暂停,做好了再继续。 a 选项,黄豆与芝麻混合,混合后的总体积小于混合前的总体积,说明分子间有间隙。 这个现象能说明黄豆之间有间隙,可以帮助我们理解。酒精和水混合后总体积变小是因为分子间存在间隙,但注意, 黄豆和芝麻都不是分子,他们的混合不能说明分子间有间隙,只能是帮助理解。所以 a 选项错误。 b 选项,物体热胀冷缩是因为分子的大小所有温度的变化而改变,这个明显是错的。分子的大小是通常不发生改变的。 物体热胀冷缩是因为分子间间隙大小的改变,它会随着温度的变化而变化。 c 选项,污水排除池塘不久,整个池塘的水都被污染,说明分子做无规则运动, 这个是液体之间的扩散现象,能表明分子在做无规则运动,所以 c 选项正确。倒选项,热水瓶平塞有时很难拔出,说明 分子间存在引力。平塞很难拔出是因为热水瓶内温度降低后,内部压强减小, 在压强差的作用下,所以屏塞有时会很难爬出,与分子引力无关,不符合题。因此本题正确。选项选择 c 选项 好。今天我们主要学习了分子动辄论的四点内容,并要求同学能运用分子动论论的内容去解释一些生活现象。这节课就上到这里,物理大师格屋之知,下节课见!
343初高中干货视频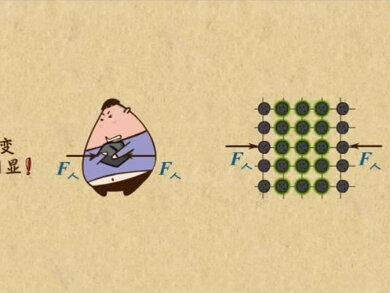 01:34查看AI文稿AI文稿
01:34查看AI文稿AI文稿之前已经说了,木质是由大量分子构成的,分子在永无停息的做无规则运动,分子间有间隙, 回来再看看这张图,这一个一个小圆粒挨的都比较近,间隙很小。没错,固体就会这样哦, 而液体、气体呢,则大致长成这个样子。三种平时常见的物态正对应了不同的分子派的样式。 那这些分子有什么特性吗?当然有,想一想现在有一个铁块能把它徒手捏成瘸子,好贱吗?显然不行,小胖子连举带拉,累的满头大汗,可铁块还是铁块, 这是为什么呀?我们再放大到这种程度看看。其实每当小胖子去挤铁块就用了力,这些铁原子自然也受到挤压。不过我们在这里看到行片并不明显,说明当我们挤压的时候, 中间的铁原子会给两侧的一个力阻碍,两侧的铁原子向中间移动,也就阻碍了铁块的形变,这个阻碍的力就是视力。而当小胖子拉伸这个铁块时,同样有力阻碍形变,这时候的力是向回拉的力,叫做引力。 看到了吧,其实分子很不好伺候,他们之间总有吃力和引力,如果离得很远,可以忽略这些力,但距离很近的时候,就必须要吃力和引力平衡,他们才能好好的聚在一起。 如果你挤压他,他们之间智力就变大,抵抗你的挤压。如果你拉伸他,他们之间的引力就变大,抵抗你的拉伸。这就是分子间的作用力。分子之间有智力和引力,他们是同时存在的,你学会了吗?
94荣县托管荣老师 02:14查看AI文稿AI文稿
02:14查看AI文稿AI文稿分子间的作用力我们知道,世界上的物质都是由分子、原子组成,而且由扩散现象表明,分子并不是安静的待在一起,而是在不停的做无规则运动。 虽然分子在运动,但是固体和液体却总能保持一定的体积,他们中的分子不会飞散开,这是为什么呢?难道分子之间有什么小秘密?到底是怎样的呢?还是先来看个实验吧。拿两个铅柱, 将两个铅柱的底面削平,削干净,然后紧紧的压在一起, 接下来把手撒开,神奇的一幕就发生了,下面的那个铅柱竟然没有掉下去, 两个铅柱结合起来了,挂上一个重物试试,依然不能将他们拉开。是什么使这两个铅柱相互吸引?这主要就是因为铅柱的原子之间存在引力, 两个铅柱由于原子的引力才会紧紧的吸在一起。也正是分子之间的引力,才使得固体和液体的分子虽然在不停的运动,但不至散开,因而固体和液体就可以保持一定的体积啦。 钢铁不容易被拉伸,也是因为分子之间的引力,但是我们同样无法轻易的压缩固体和液体,这就是因为分子之间不光有引力,还有斥力,所以当他们之间到达一个合适的距离时,分子间的作用力就 就是零。就好比人与人相处也要保持合适的距离,距离太近了没有自由,距离太远了又会觉得想念。 而当某种物质被压缩的时候,分子间的距离变小,分子间的作用力就会表现为斥力。当物质被拉伸时,分子间距离变大,作用力又会表现为引力, 这分子也实在是太傲娇了。其实不一样的分子傲娇的程度也是不同的。想知道哪种状态下的分子最傲娇,下集再见吧。
77叶子物理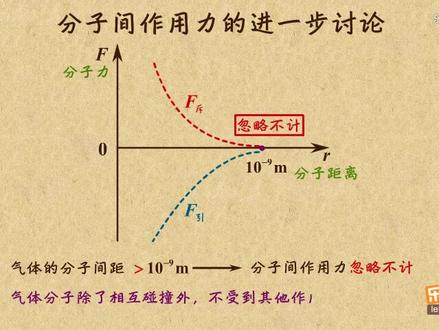 02:38查看AI文稿AI文稿
02:38查看AI文稿AI文稿这个视频咱来对分子间作用力进行进一步讨论。之前咱分析过这个图,随着分子间去的增大,引力和吃力都会减小, 如果分子间距达到分子直径的十倍以上,也就是在图中大于十的负九四方米时,分子之间的引力和吃力就都很小了, 此时分子间作用力可以忽略不计。对于一般的气体而言,分子间距都是大于十的负九十毫米的,那分子间作用力可以忽略不计。也就是说,气体分子除了相互碰撞外,不受其他作用力,是自由运动的。 那这样的话,压缩气体是不是就毫不费力呢?并不是。当你压缩气体时,虽然没有分子间纵力,但气体分子会与容器壁频繁的碰撞,这会对容器壁产生压强,你就感觉有点 费力了。所以在压缩气体的过程中,还是需要克服大量气体分子的撞击力的,只不过这个撞击力还是要小于固体和液体的分子间作用力,所以压缩气体还是相对容易的。 了解了气体分子键作用力的特点。再来说着液体,用高速摄影机记录一滴水滴入水面的过程, 可以看到水滴滴落后,上面的剩余部分迅速收缩,像这种液体表面具有收缩的趋势,就是所谓的表面张力。 原理呢是液体表面的这些分子间距比内部的分子更大,排布更稀疏,所以分子间作用力表现为引力,造成收缩的趋势,就有了表面张力。另外,当液体和固体接触时,比如在洁净的玻璃板 上滴一滴水,会发现液滴好像变扁了,晃一晃到处都是水机,像粘上去一样,换句话说就是附着层有扩大的趋势,这种现象咱称之为浸润。相反的,你看防水布料上的水珠或者荷叶上的露珠,身材就保持的很好,还是个球, 而且抖一抖就掉了四号眉粘上去,也就是说附着层有收缩的趋势,这种现象就是不进润。 这两种现象的原理都与液体和固体接触面附着层的分子密度有关。如果分子密度大,就表现出智力,那附着层就有扩大的趋势,表现为进润。但如果分子密度小,就表现出引力,那附着层就有收缩的趋势,表现为不进润。明白了吧? 通过这个视频,咱发现液体气体的很多特点都与分子键作用力有关。那这玩意从本质上讲到底是咋产生的呢?咱下个视频再说。
390玄鬒(zhen✔)子 02:09
02:09 04:49查看AI文稿AI文稿
04:49查看AI文稿AI文稿在我们这个分子间的作用力的问题上,我们讲了一句话,叫分子间的引力和次力是同时存在的,那有同学就问了,那到底是引力还是次力啊?那分子之间啊,那我们就说了 分子之间的这个引力和刺力,他表现的时候是怎么来表现的呢?首先是分子之间存在着刺力,这个刺力的表现是什么啊?分子之间存在着引力,这个引力的表现是什么?我们来看一下子啊, 固体是很难被压缩的,气体很容易被压缩是因为固体的分子之间比较近,气血分子之间的距离比较远, 当我们把气体压缩的时候,分子之间距离逐渐的靠近啊,那么这个时候他就逐渐的显示出来他有排斥力啊,那么当我们过 体的时候,他比较近,这个排湿力就比较强,气体的分子之间呢,距离比较远,排湿力就比较弱啊,因此当你压缩固体的时候,使他的间距逐渐的在变得非常小的时候,他的排湿力就显示的非常强大, 那么就显示出来什么呢?显示出来具有很大的排斥力了,那当我们把这个固体要拉断的时候,你要注意是把他的分子要分开,而他们的分子之间是存在引力的,这个时候他强大的引力就表现出来了 啊,分子和分子之间的强大引力表现出来,那么这个时候你间距变大,他就不愿意断开了是吧?你必须用很大很大的力才能把分子之间这种引力克服掉,把它断开啊,那么这时 我们在这个体现的时候,应该能够要知道的啊,那么这个在固体当中表现就非常的强大了啊。我来看一道典型例题,破镜重圆。实际上来讲是说破镜很难重圆 啊,说打碎的玻璃镜子啊,即使你把它贴的对块对在一起,缝和缝对在一起了,却不能的重新的 结合成原来那个镜子的原因是什么啊?什么原因导致的是不能破镜重圆啊? 那么首先说我们刚才讲了分子之间的引力和次力的问题,分子在不停地做无规则运动,这个 是他不能重新结合在一起的原因吗?肯定不是啊,那么因此 a 不是啊, a 不是。 b 选项,说分子之间的引力太小, 分子之间的引力看什么时候小什么时候大,当固体你要把它抻断的时候,他就显显示说强大的引力, 但是你打碎的玻璃他们之间可不是已经断开的,对吧?就像我们说把铁丝已经揪断了,然后你再对着一起,他就不能很好的结合在一起了,道理是一样的, 你认为他挨在一起了,那个缝隙好大好大呀,分子之间的间距是非常小的,所以这个不对啊。 c 选项,玻璃片间 有少数的几个点接触,大部分的断面的分子的间距都是很大的,这句话非常正确,对吧?然后说分子间没有很强的作用力,几乎是分子之间没有什么强大的作用力,因此他这个时候是不能重新的结合在一起的 啊。我们来看最后一个啊,说玻璃镜断面处靠的太近,你要真能靠近,把它靠成,分子和分子之间间距,他不就粘一起了吗?所以分子间的作用力主要是表现次理,这不对啊, 靠的太近应该表现引力啊,是因为太远,对吧?是因为太远,太远,他这个,他这个引力不够,那我们想要引力够, 能够使他真的就是靠的很近,然后并且能让他真的分子和分子结结合在一起,怎么办呢?把它融化呀。 把它融化是什么呢?我们的电焊不就是融化吗?或者说用一种融化了的啊,这个这种金属啊,比方说焊铁,你用铁焊条啪啪啪焊啊,让那地方烧红,全部热了,融化和新的融化的液体融合在一起, 那两个断面不是就接在一起了吗?是吧?那么这就是我们在这个地方当中能够要理解的啊,所以我们就选择 c。
67物理王老师 00:38查看AI文稿AI文稿
00:38查看AI文稿AI文稿分子间的作用力,取一张卡片放在杯口上,发现他不能承受一枚硬币的重力,往杯中倒满水,再把卡片放在杯口上,他就可以承受很多枚硬币了。 这个实验说明了分子之间存在隐蔽,你学会了吗?
138物理老杨 06:08查看AI文稿AI文稿
06:08查看AI文稿AI文稿第九讲分子间作用力。大家好,今天分享的是高中化学选修二第二章第四节分子间作用力的内容,点赞收藏加关注,防止需要的时候找不到。 那么之前咱们一直在研究什么分子间的作用力?分子间靠的是什么?就是靠的共加键啊,进行的作用。当然呢,如果是离子化合物里面靠的是离子键作用力结合在一起的, 那分子与分子之间有没有什么作用力呢?肯定是有的,如果没有的话,我们比如说水, 他就不是液体了,他应该是一盘散沙,瞬间的变成什么?变成水蒸气。分子离的远远的,每个分子之间,每个分子既然能结合在一起,肯定是有作用力的,那么这里面作用力一共有两种,我们依次介绍一下。首先第一个叫什么范德华丽, 关德华丽呢?这个非常好理解,我们可以理解为它就是物理上的什么万有引力定律。物理上强调两个物质,只要它有质量,无论是这个质量大也好,质量也很小也好,你有质量,我有质量,咱们两个之间就怎么样 就会存在一个引力的一个作用。我们人为什么站在地球上,就是因为地球本身它的质量特别大,所以对我们的引力特别强,对吧?这个地球引力, 那么微观上分子之间不叫万有引力,他叫什么?范德华丽,也就说你分子有没有质量,有质量,虽然你的质量很小,你作用力也很小,对吧?分子与分子之间是存在作用力的, 只要你是分子,你有相对分子质量,那么两个分子之间就会存在范德华力,范德华力是普遍存在于分子之间的。好,这个直接讲完。那么另外呢,还有一类特殊的分子,比如说 水分子,它里面除了饭的法力,还有一种比饭的法力作用还强的力,他叫什么呢?清剑。 那么这里注一定注意,他叫轻剑,他不叫某某作用力,轻剑,他不是化学剑,一定要注意,跟那个什么离子剑呐,这个共加剑呢,都不一回事。轻剑是单独的,也是一种分子间的一个作用力,这个一定要认清楚啊,他是分子间作用力。 什么样的分子间会产生轻便呢?咱们不得不说一下轻便产生的一个原因,以水分子为例啊,上节课咱们也讲过清根呀, 结合什么,对吧?我们说由于痒怎么样,他的一个垫腹性特别大,会紧密的吸引供应电子顿,所以造成了一个供应电子顿,是紧贴着养的,清理这个电供应电子比较远,那这个时候轻就显什么正电性, 阳险负点性。这个时候我们想由于氧结合的特别牢,这个清的正电性怎么样,他就凸显的特别厉害。那我们想,如果这还有一个水分子的话, 这个阳险负电性,这个清显正电性,这个正负电性之间会不会产生一点点类似于静电作用那种作用力啊?是可以的, 我们就将这种作用力怎么样?像静电一样的作用力称之为清剑啊,这是清剑的一个来源。那么能够形成清剑一般是什么?就是清和氧啊, 清和福啊,清和淡呢?这些原子之间他才会形成,因为清特别容易失去电子,而蛋养福是我们元素周期表当中为数不多的啊,氧化性或者叫做垫负性特别强的原子,他可以 把这个电子落到自己身边,让轻体现出很强的正电性,这样就可以和体现很强的负电性的原子直接形成微弱的这个轻电左用力,这是分子线左用力的由来。那么轻电这块我们要系的时候怎么系?你就系着, 有什么建?有清养建的,有福清建的,有什么有这个蛋清建的分子一般都会有情建就可以了。 那可能会说,老师我这个每个都需要分析吗?是不是每个有他们都有,这还与空分子的一个空间结构息息相关。那其实有福清建的就是谁?就是福华清,没别人 啊,有氧气垫的,这个就比较多了,除了水以外还有什么?还有像纯有机物,纯啊,纯,一般像乙醇,甲醇这里面也有,也有什么三四年作用 这种清剑啊,这个要注意一点,但是如果说这个唇腔肌特别少,然后探清特别多的那种,呃,怎么说呢,这个高级唇吧。啊,那这个时候呢,他清洁作用力就可以微乎其微了,因为有可能这个青根氧之间和另一个分子青根氧之间距离太远,够不着啊,这个作用力就忽略了。 那蛋清键一般是什么存在于?比如说那个太监呐,啊,还有什么氨基酸当中的那个氨基啊,还有氨气当中,对吧?等等,一般呢,我们就以水,纯腐化氢和氨气 这四个物质,或者叫这四类物质吧为准。清健广泛于存在于他们当中,由于有清健的存在,那正常范德华利这个利由于跟清健相比比较小,我们还考不考虑范德华利就可以忽略不计了啊?那这个时候我们他也有 特点在青化物当中,比如说,呃,正常的氟化性啊,绿化性,还有什么这个锈化性、 点化性等等,他们应该是越向下相对分子质量越大,那分子间作用力就应该越大。但是事实上,事实上绿化性是什么?绿化性是气体,对吧?腐化性是什么?腐化性就是液体。 为什么浮夸轻是液体?就是因为他分子间有什么分子间作用力。分子间作用力影响的是什么?影响的是溶沸点和溶解度, 不影响他的化学性质。他容不容易分解,容不容易发生化学反应。跟分子间作用力有关系吗?跟清洁犯的法律有关系吗?没用,这点一定要搞清楚。但是可以影响他的什么溶沸点和溶解度啊?因为你水当中有清洁,浮发性有清洁,他们 两者放在一起互不互融啊?互融对吧?水分子和什么浮发性分子和氨基分子,他之间可以形成镜片,结合的更牢固,更易相互溶解。好吧,这节课的知识点呢,咱们就讲到这,有任何问题评论区与老师互动,拜拜。
872范老师的化学自习室 01:04查看AI文稿AI文稿
01:04查看AI文稿AI文稿for the thirty day when you watch you i won the dread early jay。
1.7万地球小视 05:33查看AI文稿AI文稿
05:33查看AI文稿AI文稿我们再看第三个知识点是分子间的作用力,我们先进行一个实验探究,首先呢我们把这两个牵住,你看这两个牵住呢,把它一端呢给磨平,磨平了以后呢把它给压紧, 压紧以后发现这个牵住呢就不容易拉开了,就是两个好像粘在一块了一样,就不容易拉开了。这个说明什么?说明是不是分子间存在引力啊? 就是这两个铅块他接触的地方,接触的地方是不是存在的分子间的引力,所以说呢就不容易拉开啊? 还有呢就是我们如果说压这个砖块是不是不好压缩呀?包括压这个水,水 是不是压,压也是压不动呀?所以说呢,固体和液体呢也很难进行压缩,这说明呢,分子间是不是存在着智力啊?他存在着智力,所以说呢,我们不好呢对他进行压缩。 关于分子间引力和吃力呢,有几个地方呢是容易理解错误的。第一个呢就是分子间的引力和吃力呢,他是同时存在的,并不是说他只存在引力或者只存在吃力,他是同时存在的, 就是说分子间的作用力呢,能使固体和液体呢,能保持一定的体积。 就是说我们看如果说他只有引力或者只有吃力,那么固体和液体是不是就不能保持一定的体积了呀? 就是因为引力和赤力呢相互平衡,所以说呢,能够保持一定的体积。还有一个呢就是分子间的赤力呢,是物体和液体呢,很难被压缩,所以说我们只要考到物体很难被压缩了,那么就是因为分子间呢存在着赤力。 好,下面呢我们利用类比法呢去理解一下分子间的引力和吃力的关系。我们把分子间的引力和吃力呢,我们比喻为弹簧,我们看假如说 假如说这两个分子他的小于平衡距离的时候,我们先看平衡距离吧,等于平衡距离的时候,是不是他的作用力为零呀?然后就相当于弹簧的圆长,圆长的时候呢,也都 没有弹力,而小于平衡距离的时候,他是不是有一个炽力,然后包括这个弹簧,如果说我们压缩弹簧,那么这个弹簧是不是有一个弹力向外啊?有一个向外就相当于是这个分子的炽力。 同样的,如果说我们把弹簧呢进行拉长,拉长以后,弹簧是不是有一个向内的力啊?一个向内的力,就好比说 这两个分子呢,他大于平衡的距离,他们呢会有一个引力,所以说我们要利用弹簧呢去类比理解一下, 这样的话我们会更容易理解一些。下面呢我们看一下物质三肽的微观特征,也就是说在气态、 液态和固态三种状态下,他的分子的微观表现和宏观表现。我们看先看气态,我们看气态,他们的分子间的距离是不是比较大, 他的微观表现呢就是容易被压缩,易被压缩,然后呢具有很强的流动性, 宏观表现呢就是分子呢高速运动,分子间的作用力呢很小,作用力呢很小,我们看分子间作用力最小的是什么?就是气态 好,我们再看液态,液态的分子模型呢是长这样的液,液态呢,他是脚难被压缩,没有确定的形状,就是因为没有确定的形状,所以说呢,具有流 流动性,液态的,它的分子呢是运动比较自由,分子间的自由力呢也是比较小的。 然后我们再看固态,固态呢是不是就是排列很整齐,是不是横向纵向都排列呢?特别的整齐,是具有一定的形状和体积,就体积的形状呢,都是固定的 分子,排列呢比较紧密,然后呢作用力呢也比较大。我们看到例题,固体呢,很难被压缩,是因为固体分子之间呢存在什么?我们看到压缩了, 我们看一个固体压缩压不动是因为什么?是不是因为存在分子间存在智力啊?同样的,我们说如果看到分 固体呢,很难被拉伸,那么是因为什么?拉拉拉不动,那么就是因为固体分子之间呢存在着引力,是不是?所以说这一段呢,什么时候填引力,什么时候填智力呢?大家呢一定要理解。 我们再看第二,问说黄金、水和空气三种物质中,分子间作用力最弱的是什么?我们看刚才呢,我们已经分析了,气体呢,他的分子作用力呢是最弱的,而固体的分子作用力呢,是最强的。
153小智微课堂 02:09
02:09 03:19查看AI文稿AI文稿
03:19查看AI文稿AI文稿这个视频我来讲讲分子间作用力。先来看这组数据,水从固态变为液态美摩尔需要六千胶能量。从液态变为气态美摩尔则需要四十四千胶能量。 这就怪了,从固态到气态,水分子本身并没有发生变化,只是分子间的距离变大了,为啥还需要能量呢? 真相只有一个,那就是水分子之间还存在着某种作用力,在物态变化的过程中破坏了这种作用力,所以才需要能量。 这种作用力就是分子间作用力,准确定义就是把分子聚集在一起的作用力。你也可以叫他范德华丽, 这是为了纪念荷兰物理学家范德华老爷爷在这个领域的研究与贡献。你如果足够勤奋,将来也许会有张三立、王大锤守恒之类的名。 呃,言归正传,分子间作用力的实质是电信引力。接下来咱们看看分子间作用力的主要特征。第一,只存在于分子和分子之间,原子和离子间是木有地。 第二,只有分子间充分接近时,才存在分子间作用力。比如固态和液态物质中,分子间距离较小,分子间作用力就比较明显。而气态物质中分子之间的距离很大,分子间作用力就非常微弱,一般都忽略不计了。 第三,分子间作用力远弱于化学键。我给你举个实力,刚才水分子雾态变化时,破坏分子间作用力所需的能量你已经知道了, 如果是气态的水分子变成清源子和氧源子,就要破坏氢和氧之间的急性键,需要的能量远远大于上面这个。 所以说,分子间作用力要远弱于化学界。第四,由分子构成的物质,其熔点、沸点和溶解度等物理性质主要由分子间作用力的大小来决定。这个好理解,因为由分子构成的物质,比如干冰,它的晶体是由二氧化碳分子构成的。 咱也知道二氧化碳分子由碳氧原子构成,显然,二氧化碳分子间存在着分子间作用力,分子内才是碳和氧形成的急性公家舰。 如果发生物理变化,比如干冰的奢华,破坏的就是分子间作用力,但化学间并没有被破坏,所以这些物理性质主要由分子间作用力的大小来决定。 怎么样都明白了吧?最后再说说影响分子间作用力大小的因素,你要记住,组成与结构相似的物质,相对分子质量越大,分子 作用力就越大。看这个图,咱比较一下卤素单制的融沸点与相对分子质量的关系。显然,从服务到点,相对分子质量越大,融沸点就越高,这就说明了分子间作用力越来越大。 以上就是这个视频的全部内容,但认识了分子间作用力,他也叫范德华丽,实质是电信引力。你要记住,分子间作用力只存在于分子和分子之间,只有当分子充分接近时,才会存在分子间作用力,他的强度要远弱于化学间。 而对于由分子构成的物质,其容点、沸点和溶解度等物理性质,主要由分子间作用力的大小决定。 最后,对于组成个结构相似的物质,相对分子质量越大,分子间作用力也就越大。好了,就说这么多,练习走起吧!
492在线学习高中部
猜你喜欢
最新视频
- 6986百川智育






