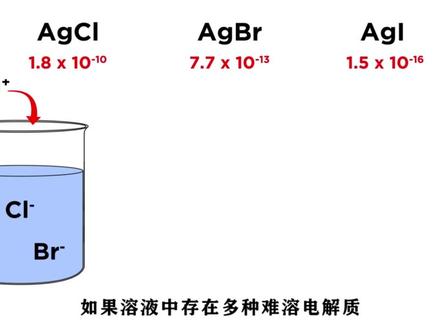
沉淀溶解平衡影响因素
粉丝378获赞1697
相关视频
 00:50
00:50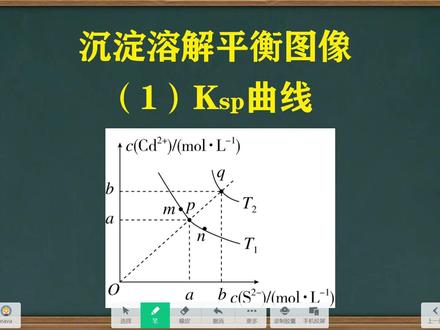 06:02查看AI文稿AI文稿
06:02查看AI文稿AI文稿大家好,今天我们来讲解沉淀溶解平衡的图像。沉淀溶解平衡经常考察的图像有三种,第一种是 ksp 曲线,第二种是对数图像,第三种是低定图像。这三种图像同学们哪一种掌握的不太好呢?可以在弹幕里面投票。 我们今天先来看一下第一种图像,就是 casp 曲线。以硫化格为例,硫化格是一个难溶物,它在水溶液当中可以微量的融入极少量的隔离子和琉离子。 溶度级常数 k s p 可以写为隔离子的浓度乘以琉离子的浓度。 k s b 曲线呢,类似于一个反比例函数, 我们知道反比例函数的特点就是在这条线上的所有点的横坐标和纵坐标的乘积都是一个定时。而对于沉淀溶解平衡来说,当温度一定时, k s p 也是一个定值。 所以说 k s p 曲线就是一个反比例函数。图中横坐标表示琉离子浓度,纵坐标表示隔离子浓度。当温度为 t 一时, t 一线上的所有的点横坐标和纵坐标的成绩都等于该温度下的 k s p。 所以说呢,在这条线上, n 点、 m 点和 p 点的 k s p 是相等的, 当温度为 t 二的时候, k s p 是另外一个值。 t 二温度下的 k s p 和 t 一温度下的 k s p 是不相等的。 很明显, q 点的 k s p 是要大于 p 点的 k s p 的。既然在线上的所有点都是达到了沉 电溶解平衡状态,电两侧的点都是没有达到沉淀溶解平衡状态。我们以 t 一温度为例,在 t 一这条曲线的左下方这个区域, 溶液当中离子浓度的浓度商 q 值是要小于 p s p 的溶液是未饱和状态, 而在 t 这条曲线的右上方,例如这里有一个 f 点, f 点的横坐标和纵坐标的乘积是要大于 t e 这条线上的点的。所以说, f 点 浓度商大于 k s、 p 是一个过饱和状态,过饱和状态非常不稳定,有沉淀生成。我们来看一道具体的题。 硫化格是一种难溶于水的黄色颜料,其在水溶液当中的沉淀溶解平衡曲线如图所示。下列说法错误的是 a 选项,图中 a 和 b 分别表示 t 一、 t 二温度下硫化格在水中的溶解度 好, a 点和 b 点分别表示 t 一温度和 t 二温度下隔离子的浓度。所以说呢,可以表示硫化钾在水中的溶解度。 硫化革在水中的溶解度啊,在高中阶段,溶解度可以表示为沉淀溶解到溶液当中的离子的浓度。 b 选项,图中各点对应的 k、 s、 p 的关系好,我们知道 m 点应该是等于 n 点, n 点等于 p 点, 而 m、 n、 p 都是小于 q 点的。所以说这里啊,这里他写错了, b 选项是错误的。 c 选项,向 m 点的溶液当中加入少量的硫化钠固体,溶液组成由 m 沿 m、 p、 n 线向 p 方向移动好, m 点是一个沉淀溶解平衡状态, 在这样一个状态的溶液当中加入少量的硫化钠固体,大家注意,不要看到是一个固体啊,就认为它也是个沉淀。我们知道所有的钠盐都是可溶的,所以说像溶液里面加入硫化钠,相当于加琉离子,溶液当中琉离子的浓度会上升, 意味着硫化钾的沉淀溶解平衡要向逆向移动,隔离子浓度会下降。 但是呢,即便是加了琉璃子,溶液当中依然含有硫化格沉淀,就依然是沉淀溶解平衡状态。 m 点在移动的稍微仍然在 t e 这条线上移动,不会到线外去,这点同学们要注意。 那 m 点是向右下方移动,还是沿着 t 这条线向左上方移动呢?横坐标是琉离子浓度,琉离子浓度减增大,所以说横坐标要往右移,而隔离子浓度下降之后, 隔离子作为纵坐标要往下移。所以说要沿 m、 p、 n 这条线向 p 方向移动, c 选项是正确的, d 选项温度降低时, q 点的饱和溶液组成,由 q 沿 q p 线向 p 方向移动。我们来看啊, q 这个点横纵坐标是相等的,都是 b。 摩尔美声,我们可以看成啊,这里有一定量的硫化格沉淀, 然后呢,加水,这样的话,它的上氢液当中隔离子浓度就等于琉离子浓度,就相当于沉淀自然的溶解到溶液里面两种阴阳离子,并且浓度是相等的,一比一的。 如果将 q 点的温度降低,绝大多数沉淀溶解平衡的 darth 是大于零的,也就是一个稀的反应。当温度下降的时候,平衡向逆向移动,溶液当中的隔离子和琉离子的浓度减小, 沉淀量增多,那么 k s p 也要下降,因为 k s p 等于离子浓度的乘积。
120高中化学大熊🐻❄️ 07:20查看AI文稿AI文稿
07:20查看AI文稿AI文稿我们来说一下这个沉淀溶解平衡,呃,这个沉淀溶解平衡呢,一般来说呢比较难理解啊,但是呢,呃出的题目呢是比较简单的,在高考当中啊,他一般就在后面的填空题出现几个空, 现在呢,我玩那个呃溶液平衡那道选择题也会考这个陈建溶液平衡,但是只不过是拿这个作为背景来考啊,他考的东西呢?还是溶液平衡里面的其他知识 啊?我们先从这个概念开始讲,什么叫沉淀溶解平衡,我们一般写沉淀溶解平衡的时候啊,就写这个固体变成离子啊,是一个颗粒符号,呃,他这个是一个呃省略的写法,我们拿这个碳酸钙来说啊,就平常我们写的时候呢啊,就是碳酸钙啊,固体 啊,颗粒符号啊,变成盖离子加上碳酸根。哎,我们一般是这么写,他其实呢他这里面有个过程, 就是碳酸钙固体我们往水里面加,他是一个男人物,我们稍微多加一点呢,他就不融了,但是他总会溶解一部分,那这个固体和这个溶解的这一部分呢?这个碳酸钙呢?啊, 他是一个啊平衡那溶解的这个碳酸钙啊,我们的碳酸钙是一个强电解质啊,强酸强碱啊,还有盐,绝大多都是盐,都是强电解质,那碳酸钙在水里面呢,他就会完全电离成这个钙离子 和碳酸根,我们把这两部啊合在一起,就是上面这个狮子啊,就变成上面这个。 他实际上是有个过程啊,第一步是坑内的,第二步呢,他是一个完全定理的,是打一个等号的啊,这个是陈年溶解平衡他的一个来源啊,那么我们平常会遇到这个陈年溶解平衡的 ksp, 他的 ksp 表达是呢,拿这个他的爱来做 例子呢,就是钙粒子浓度乘以这个碳酸根浓度,因为碳酸根,呃,碳酸钙呢?它是个固体,是不能写在这个啊, ksp 表达式里面。这个呢?呃,它有点像开 w 啊,这是离子机啊,那个是水溶液状中的氢离子和抢格的成绩 啊,这个呢,是啊,盐电离出来的离子啊,他的离子机。那一般沉淀溶解平衡呢?我们会啊,遇到的问题啊,常见的是有四个啊,第一个呢,就是啊,什么时候开始沉淀? 我们做工业流程题,经常会遇到像这个三价体啊,呃,一般啊,几点几?撇去知,二点几他就开始沉淀了啊,三点几他就沉淀完全了。那这个开始沉淀呢,经常是一个问题, 呃,有时候会问你,他开始沉淀时候的啊,离子浓度,也有时候会问你,他开始沉淀时候的偏休值啊,比如说这个,刚说这个 三价铁呢,他经常问你啊,骗取值等于几的时候开始沉淀。那遇到这种题啊,怎么算呢?我们拿这个碳酸钙来举例子,呃,我胡作一个数据啊,就是 k s p。 碳酸钙呢啊,甲屎等于十大啊,腐蚀次方 啊。那我现在呢,有一个溶液,这个里面呢是氯化钙啊,氯化钙水溶液啊,氯化钙的这个浓度呢是零点一摩尔啊,美神啊,然后我这个溶液当中我加碳酸根离子,然后不能只加碳酸根离子啊,我比如说我加的是碳酸钠, 加了这样一个固体啊,也加进去,当这个碳酸根浓度是多少的时候就会出现碳酸根啊,碳酸钙的这个成见的,只要 啊这个盖里子和碳酸根他的乘积呃是等于十的负十四方啊,他就开始沉淀了,那么取这个零件也就是他们等于十的负十四方的时候就开始 啊,那也就是说算这个碳酸根的离子呢,就是你用开斯 p 这里的开斯 p 除以这个盖里子浓度就可以了啊,开始沉淀。呃。第二个呢是什么时候完全沉淀,完全沉淀, 这个完全沉淀这个完全这两个字呢?并不是我们所理解的,就是啊,这个梨子在水溶液当中一个都没有,那这是不可能的,只要你这个有固体存在,他一定会溶解啊,溶解的再少他都会溶解一点啊。那我们一般认为呢,就是说当这个梨子啊,当这个梨子,比如说这里啊哈,拿这个钙离子来说啊,就是钙离子浓度 小于等于十的负五次方的时候,我们就认为他没有了啊,可以忽略不计了。但这个数据有的时候呢,你要看题目给他啊,有的时候他十的负四次方啊,一般我们认为是十的负五次方。呃,那同样的呃我们什么时候能看到 这个钙离子是小于十的负五次方呢啊?我们拿这个 ksp 除一下就知道,就是此时的他算跟离子浓度等于啊 ksp 除以这个十的负五次方算出来,就是啊,他算跟所需要达到的这个离子浓度,这个时候他就完全沉淀了。第三个问题呢是沉淀的状,呃沉淀的先后 啊,我们换一个例子来说啊,呃我们知道呢,这个绿化银、绣花银、点化银都是沉淀,而且他们的溶解度越来越小,也就是说他们的 ksp 是越来越小的,加上我有一个溶液,它里面含有啊,比如说他含有氯化钾,也含有这个绣花钾, 并且呢并且呢,这两个呃溶制的浓度是一样的,大家都是零点一摩尔每升,这个时候我 往这个溶液当中加入硝酸饮,嗯,消酸饮加进去,那哪一个鲜沉淀呢啊?呃,如果给你开 cp, 你当然可以去算啊。呃,我们不去算,我们大概的理解就是那肯定是开 cp 或者说溶解度小的那个鲜沉淀。 我们刚刚说开始沉淀的时候呢啊,就是 ksb 除以这个啊,原本溶液当中这个离子的浓度,他们浓度都是一样的,都是零点一墨尔本山那,呃,用 ksb 除以这个零点一,哪一个小哪一个就先啊,达到这个浓度啊,就是银离子能先达到这个浓度 啊,所以沉淀的先后,一般情况是,呃,开 cp 小的啊,就是先沉淀,但如果他的这个形式不一样啊,就是这个沉淀这个物质的啊,形式不一样,比如说原店高考考的是什么?绿化营啊,绣花营啊,还有这个葛酸银,那葛酸银他两个赢例子,那开 spp 的表达是是不一样的, 那你最好去算一下啊,不要去看到这个啊,就是说开撕皮小的就先沉淀啊,这算出来结果是不一样的,这是第三个叫沉淀啊,先后最后一个就是一个叫沉淀转化。 这个沉淀转化呢啊,我们还是拿这个啊,绣花印跟点花印来看,假设我们这个溶液现在有一个平衡,就是绿化印 啊,他已经是一个沉淀平衡了,沉淀溶解平衡啊,变成绿粒子和银粒子,这个时候我往这个溶液当中加入这个锈粒子,你把锈粒子加进去之后呢,他会和,就是银粒子和这个锈粒子,他会形成一个新的平衡 啊,现在平就是形成这个绣花印啊,因为你加的是秀丽子,会导致这个 盈利子啊,这个盈利子减少,导致第一个平衡呢啊,右移,右移呢,最后他形成了这个绣花银,那么我们这么看这个箭头呢,他就是六划银到绣花银这样一个转化,那么沉淀转化他有一个趋势,这个趋势就是朝 csp 小的方向,或者叫溶解度小的方向。 呃,不是说反过来不行,反过来也可以,也会有一定的这种转化,只是趋势是朝溶解度小或者烧焦,看似比小的发芽。 大概呢?呃,这块的这个问题就是常见的就这几个,当然把它变成一个。呃,图像题呢,他考的时候呢,有时候会是曲线,有时候会是直线,那个你就参照那个 kw 的这种题去写就可。
448AmosJo 03:21
03:21 03:06查看AI文稿AI文稿
03:06查看AI文稿AI文稿上来就看横纵坐标之 ksp 图像的看法,这个视频更的呢,就是你们想看那个 ksp 图像了啊,其实我觉得 ksp 在电离水野,其实它非常简单,而且比较独立,跟电离和水野几乎没有任何关系啊。来,看这题,来, 这题给了一个图像是吧,两个那个直线啊,然后给了两个沉淀的 ksp, 这两条线分别代表什么物质啊?那咱拿到图像,我第一反应是啥知道不? 第一反应看什么?第应该看横纵坐标代表什么含义,能听懂吧?好,你看来这个是 ps 二复制啊,什么意思?咱学过 p 没?咱其实学过啊,学过啥?是不?学过 ph 对不对?那你想来, 你说这 p h 等于三什么意思?氢离子浓度等于十的负三对不对? p h 等于七呢?氢离子浓度等于 石的父亲,所以得出什么结论? ph 越大,氢离子浓度数越小,能理解吧?所以 p 浓度跟浓度是成反比的,能听懂哈,所以相当于这个图越往右走,琉璃子浓度怎的数越小,对吧, 明白吧?咱把这图换成人话啊,来看这个来, pm 什么意思? m 就是各种阳离子啊,还是问题啊? pm 跟 m 的浓度是不也成反比对不对?所以图像越往上跑, pm 越大, m 的浓度就越小是吧? 好,咱们把这图的坐标分析完了,第一步结束是吧?来看第二步找呗。你看啊,这个 carpet 等于啥知道吧,是不?铜离子乘以琉璃子是不是好,这个呢?是不?猛离子乘以琉璃子是吧?好,那就找 喂,你看啊,特别简单,你看啊,咱就画一条竖线就完了呗,对不对于耶,这有点瓢,没事啊,对于这个竖线来讲,流离子浓度数都是死的,能明白吧?那你看这两个对应的纵坐表,这个数是不就是 这个 m 离子的浓度是吧?那简单的,你看这边是不是 m 离子特别小对不对?特别小的不就是这个吗? s 固定了他比他小,他的乘积在比他小,能听懂吧?所以小的就是同离子对不对?大的就是猛离子吧,完事了。所以你看上面是不是 m 小,那就是谁呀? 是不就是同理指,对吧?这是停,这是停是吧?所以这条线是不就是 c y, 对吧?那这条线呢,是不就是 i m n s 的?没毛病,是不是?再赠个支点啊?赠个啥?你想想来,对于 cos 看着没?这个线上面的东西是不是离子浓度特别小,对不对?所以上面叫不饱和溶液啊, 那馅底下的呢,是不是离子浓雾特别大,所以这是不是相当于叫过饱和,容易都开始沉淀了对不对?这就是 carb 图像看法啊, 所以记住了,一定要看。啥图像,一定要找横纵坐标代表什么含义啊? yes, 明白没?
816化学李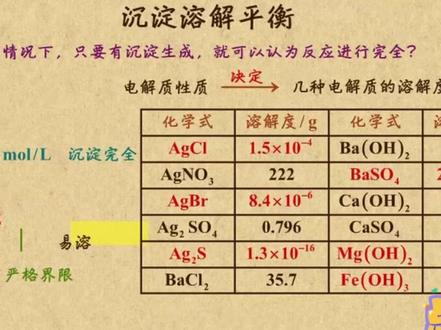 03:18查看AI文稿AI文稿
03:18查看AI文稿AI文稿这个视频咱来讨论一种新的化学平衡,沉淀溶解平衡。所谓沉淀溶解平衡,就是在一定温度下,当沉淀溶解速率等于沉淀生成速率时,物体的质量和溶液中各离子的浓度保持不变, 此时沉淀达到了最大溶解,形成了饱和溶液。比如,在二十摄氏度时,绿化银的溶解度为一点五乘十的负四次方克,换句话说,一百克水中只能溶解一点五乘十的负四次方克绿化银。虽然绿化银溶解度很小, 但告诉你他并不是完全不溶解的。进一步的从固体溶解平衡的角度来理解氯化因沉淀在溶液中存在这两个过程,一方面,在水分子的作用下,少量的银离子和氯离子脱离氯化因的表面融入水中。另一方面, 溶液中银离子和氯离子受氯化因表面阴阳离子的吸引,回到氯化因的表面吸出沉淀。一旦沉淀溶解和生成的速率相等,就得到了氯化因饱和溶液。因此,沉淀和溶液之间存在着这样的动态平衡。 问题来了,为啥在通常情况下,只要有沉淀生成,就可以认为反应进行完全了呢?回答你之前,当先来看二十摄氏度时几种电解质的溶解度, 你会发现不同电解质在水中的溶解度有着很大的差异。比如,绿化银的溶解度为一乘十的负四次方克,硝酸银的溶解度为二百二十二克。当知道他们溶解度的大小归根到底是电解质本身的性质所决定的, 但难溶电解质与易溶电解质之间并没有严格的界限。习惯上将溶解度小于零点零一克的电解质成为难 难溶电解质,比如氯化、因锈化、因硫化、因硫酸倍氢氧化酶和氢氧化铁等等,都是难溶电解质。而对于常量的化学反应来说,零点零一克是很小的。因此,一般情况下,相当量的粒子相互反应生成沉淀,就可以认为反应完全了。 另外,化学上通常认为,当残留在溶液中的离子浓度小于一乘十的负五次发膜,而每升时沉淀就达到完全。 不过要注意一点,难溶电解质的溶解度尽管很小,但不可能等于零,比如硫化盐的溶解度为一点三乘十的负十六次方刻。看来,难溶电解质在水中都是存在溶解平衡地。 最后,我再说说溶解平衡的特征,和化学平衡一样,也具有五大特征,分别为腻、 溶解和沉淀是可逆的等。溶解速率与沉淀速率相等, do 体系处于动态平衡,也就是说,溶解速率和沉淀速率虽然相等,但都不等于零。 定达到溶解平衡后,溶液中各离子的浓度保持不变变,改变条件,平衡就会发生移动,但过一段时间后又会达到新的平衡状态。 以上就是这个视频的全部内容,首先,难溶解质在饱和溶液中都存在溶解平衡。其次,溶解平衡的五大特征分别为逆、等、动、定、变。好了,饭饭也要去沉淀一下,你呢?刷题去吧!
167H20 12:04查看AI文稿AI文稿
12:04查看AI文稿AI文稿第二、第三个问题啊,溶度机既然它是一个平衡,它就有长数,是平衡就有长数,那这个长数是什么呢?这个长数叫溶度机啊,我们用 ksp 来表示, 它指的是离子的浓度的密的乘积,就叫做溶度机场数。 比如说绿化银,我们看屏幕,绿化银升成银离子和绿离子,银离子他前面的系数啊,大家注意他前面这个系数啊,按照这个表达是系数做指数,对吧?因为银离子前面是一,所以他的 他前面的系数是一,他的指数就是一,所以绿化人 ksp 我们就有了,哎,这个 ksp 是个长树纸,和温度有关,它反映了物质在水中的溶解能力,需要我们记住加油。 溶解是吸热的,绝大多数溶解是吸热的,所以这 ksp 也受温度的影响,怎么受具体受温度影响就是你升温的时候 ksp 会增大啊。 这是我们书上给我们列出的常见的南中电解局的熔柱机场书。我们看到这个绿化银 是吧?我们看看借助绿化银这个数据,我们能不能来解决一下我们刚才最初提出的问题。我们最初提出的问题就是给我们这 零点零一二的绿化银,绿化那种银和这零点零一的硝酸银,能不能让银离子 充分沉淀,还剩多少啊?还剩多少叫不叫完全沉淀?我们具体来算一下。根据绿化银, 我们先写出他表达式,沉淀溶解平衡的表达式写下来,沉淀溶解屏,他的 ksp 就等于银离子的浓度乘以绿离子的浓度。 那在这个问题当中,结合我们这里的银离子和绿离子的反应生成 放绿化饮,那么银离子投料 零点零一乘以一乘以十的负三次方,绿离子的头料零点零一二乘以一乘以十的负三次方,因为他给的是毫升,是吧?所以这绿离子过量了,也就是说反应后,这个绿离子的 绿离子的的浓度应当等于零点零一二乘以一 乘以十的负三。其实这个后面这个十负三成不成都一样啊,但我我就给他大家写完整,零点零一消耗掉的绿粒子乘以一乘以十的负三字除以呢, 二乘以十的负三次方。大家注意啊,这个两个体积混合的一毫升,一毫升加在一起两毫升,这个算完了呢,上面是零点零零二,下面是二,所以他的浓度就是零点零零一。我没事, 我们把这个零点零零一模每升代入到 ksp 中, ksp 一点八乘以十的负十字法,等于 银离子的浓度乘以零点零零一,所以要这样,我们就求出来银离子的浓度等于一点八乘以,这是十的负三,所以一点八乘以十的负七次方,我们从这里来看,他小于了 一乘十的负五次方,我们认为它完全沉淀,但是即便如此啊,这个银离子的浓度完全沉淀了, 那是不是就达到了水生植物的生存标准呢?也不一定,因为不同的物质啊,不同的鱼类啊,他对于这个影响是不一样的。 好,通过我们刚才这一组计算,我们应用到了 ksp 作为一个沉,这个溶度机长数啊,沉电溶解平衡当中溶度机长数,我们能够结合这个计算来把它算出来, 是吧?这一点定量分析角质于我们之前对于溶解度的概念认识就不一样,换了个角度,溶解度受温度影 想啊,但是他是从质量的角度去进行分析,而我们在这里是从物质的量角度去进行分析。第四个问题,关于溶度机和离子机的关系。 溶度机 ksp 和 q 的关系,这个 q 是什么? q 是某温度下有关离子的,他没有说是建立平衡状态下有关离子的浓度密的成绩, 然后这相对大小来判断他是否有沉沉淀生成还是溶解啊,来判断,当 q 大于 ksb, 他表达是计算方式是一样的,有沉淀生成,这是什么意思呢?我们解释一下啊,你看啊,刚才我们分析的问题 就是一毫升零点零一硝酸盐, 一毫升零点零一二绿化,那然后呢,这个 ksp 等于一点八乘以十的负十字法,按照我们的头量这答等题混合,那么求 q, 那就应当等银离子浓度,银离子浓度零点零一除以二乘以绿离子能度零点零一二除以二,这二是怎么来的?因为等体就混合了,这样我们算出来整理一下。下面 四,上面是一点二乘以这十的负二,这是十的负三,一点二乘以十的方,这十的负四次方,所以等于 三乘十的负五次方,那显然是大于 ksp, 所以按照咱们刚才说的那头料,那肯定是 qc 大于 ksp, 所以按照咱们刚才说那时间当中他肯定是生成沉淀,所以咱们就哎了解了这个,如果我们记住了这个,下面两个就能记住了啊,刚 q 等于 ksp 的,那就容易达到饱和呗。 啊,小鱼它没有饱和,还能够继续溶解。 结合我以上所说的这问题, 你对于 ksp 的问题我们再回顾一下,这是我们学习沉淀溶解平衡学,学了一个新长数,学了一个新平衡,一个新平衡啊,对应他表示了他的溶解能力,而这种溶解能力是从浓度这样的一个角度衡量,而不是从质量角度去衡量的。 他也要结合我们这个物质结构啊,得化学师, 化学师,你绿化人的跟流化人的就不一样,你绿化人 ksp 等于什么?等于银离子浓度乘以绿离子浓度,你开 sp 硫化银,那就不一样,那等于银离子浓度的平方乘以 琉璃子能涂,对吧?因为这两个的化学是不一样,你这个可以看成是 ab 型,这个呢,我们可以把它看成叫 a 二 b 型, 你说 ab 型和 a 二 b 型,哎,后面我们就要讲 ab 型和 a 二 b 型,这个比较的时候,我们就要重新讨论。第二, ksp 纸和温度有关?没错啊,身高温度 ksp 增大,因为人家这是个吸热过程吗?溶解是个吸热过程 对吧?大部分的溶解都是吸热过程,请看问题。第一个,陈健,溶解平衡达到,达到平衡的时候,溶脂离子浓度相等且保持不变。保持不变正确,但相等可就不一定了,这和溶脂是 什么样的物质有关?你说绿化银银离子等于绿离子没问题啊,是不是就是你要说这个硫化银, 你还能等吗?肯定等不了了,银离子就是琉璃子二倍,这是还在纯水当中。你再看我们第二个问题,但是绿化银在水中溶解度,小鱼在食盐中溶解度 绿化银。绿化银如果没有其他离子的情况下, 银离子和绿离子的浓度应当是相等。但是如果你看我们前面讲那个当绿化,那你多放多放绿化,那的时候银离子完全成了。可是绿离子 就我们前面刚说的那个除淫的那问题,那绿离子就多,对吗?当绿离子多的时候,我们从这平衡的角度来看,绿离子多了,平衡向逆向进行,所以哪个溶解度小,食盐水中的溶解度要小, 因为食盐水当中有大量的绿离子,使这个平衡逆向进行。 二、 b 选项,硫酸贝在同浓度的硫酸钠溶液 和硫酸铝溶液中溶解度相同,错,看硫酸根的,这才一个硫酸根,这仨硫酸根四升高温度溶解平衡一定重要,这肯定错, 那你得看他到底是吸热还是放热啊?大多数是吸热,那你有小数是放热也不行。为减少洗涤过程中固体的损耗,最好选用吸硫酸代替水来洗。硫酸倍硫酸倍 平衡表达式写出来, 拿进吸硫酸,那就是为了提供硫酸根,硫酸根,使得这个平衡怎么样逆向进行,降低了它的溶解,这正确。 第六,饱和的气氧化钠溶液中饱和啊,加入少量氧化钠恢复为原来的温度时,那 离子总数不变,肯定变少了。饱和的,你这里氧化,那 是不是得和水反应生成氢氧化钠呀?消耗掉水了,水少了,能融进去的溶植的量也少了。
 09:32查看AI文稿AI文稿
09:32查看AI文稿AI文稿各位同学大家好,我是大熊,今天我们来讲解一下沉淀溶解平衡的第三类图像,滴定图像 来看这道题。沉淀滴定曲线是沉淀滴定过程当中构成难溶电解质的离子浓度与滴定剂加入量一般是体积之间的关系曲线, 用零点一摩尔每升的硝酸银滴定五十毫升零点零五摩尔每升的氯离子的滴定曲线,如图所示。回答以下四个问题,我们先来看一下它的量。 滴定剂是银离子,就是硝酸银溶液,银离子的浓度为零点一摩尔每升,好用它来滴定浓度是零点零五摩尔每升体积为 为五十毫升的氯离子,氯离子是被低定物,我们看一下这个低定曲线啊,它类似于一个酸碱综合反应的低定曲线,也就是说它也有一个凸越,在斜率最大的这个点应该是 c 点, 氯离子的浓度变化是最大的,因此在这个 c 点,这个凸越点,银离子和氯离子应该是恰好完全反应,就像那个酸碱综合反应一样啊,也是在凸越点是恰好完全反应,恰好完全反应的意思就是滴定剂银离子和被滴定物氯离子 物质的量之比为一比一,刚好生成绿化银沉淀溶液当中氯离子也不剩余,低定剂银离子也不过量四十 状态,就是下方有绿化营沉淀沉淀上方相当于纯水, 因为没有银离子和绿离子过量,但是我们知道纯水当中肯定有少量的绿离子和银离子,那么这个少量的绿离子和银离子也是要靠着氯化银哎溶解进去的。 由于没有银离子和绿离子过量,所以说溶解到上方纯水当中的银离子和绿离子的浓度应该是一比一的。也就是说,每溶解一个银离子到上青叶当中,就溶解同时溶解一个绿离子到上青叶当中。 如果是一百个银离子溶剂群,那么就有一百个绿离子溶剂群,所以说两者是一比一的。因此,在 c 点恰好完全反应点,银离子和绿离子的浓度是相等的,所以说我们就可以用 c 点来计算,沉淀的 k s p。 氯化盐的 k s p 等于饱和溶液当中银离子浓度乘以氯离子浓度。由于在 c 点银离子和绿离子浓度相等,所以说呢, k s、 p 就等于溶液当中的氯离子浓度的平方。 那根据 c 点图中的纵坐标,四点七五左右,氯离子的浓度就应该等于十的负四点七五, ksp 等于他的平方等于十的负九点五次方。 第一问,问的是 k、 s、 p 的数量级是多少?十的负九点五次方的数量级啊,我们可以将它拆成十的零点五减十次方,也就是说等于 大零点五次方乘以十大负十次方,那么数量级也就等于十的负十了。 第二问,低定终点 c 点为饱和绿化银溶液,刚刚我们已经分析过了啊, c 点的特殊之处在于, c 点是一个恰好完全反应点,两个离子都不剩余,不剩余的情况下,那么上清页当中的 极少量的银离子和绿离子要靠沉淀溶解进去。银离子和绿离子浓度是相等的,因为氯化银每溶解一份银离子,就同时溶解一份绿离子到溶液当中 括号三相同实验条件下,若改为零点零四摩尔每升的氯离子反应终点 c 点向哪个方向移动?如果将溶液当中的氯离子浓度啊,由零点零五改成零点 点零四摩尔每升的话,那么低定终点啊,也是恰好完全反应点,这个我们要知道。那么如果将氯离子的浓度降低,只是氯离子的物质的量减少了,物质量等于由原来的零点零五摩尔每升改成零点零四。 完美声好,这是 c, 然后乘以这个体积 v 仍然等于五十毫升,那么它应该等于等于左边 银离子的物质量啊,这是绿离子的物质量,应该等于银离子的物质量的时候是低定终点,那么银离子的物质量等于银离子的浓度零点一乘以它的体积,体积我们可以设为 v 啊。 好,那这个零点一 v 应该等于后面的零点零四摩尔每升乘以五十毫升,也就是这两个点相等,零 点 ev 等于零点零四乘以五十毫升啊,零点 ev 是银离子的物质的量, 零点零四乘以五十毫升等于氯离子的物质热量啊,这两个得相等,那么由这个关系质可以解出 v, 银离子 等于零点零四乘以五十毫升,再比上零点一摩尔美声应该等于一个二十毫升。 所以说,如果将绿离子浓度下降的话,需要的银离子的体积也会相应的减少,因为两者要保证一比一的时候才是必定终点。 也就是说,要由这个 c 点向左边移动, 横坐标银离子的体积要减小啊,移动的哪 位置?移动到横坐标为二十毫升的时候到达地定终点,因此反应的终点 c 向 a 点方向移动,但是不是移动到 a 点,而是移动到 a c 之间的一个点。横坐标为二十的时候,我们可以标为 d 啊,就是移动到这个地点, 在移动的过程当中,是平行于横坐标进行移动的,也就是说低定终点的纵坐标是不变的。这是为什么呢? 这是因为浓度为零点零五摩尔每升的氯离子和浓度为零点零四摩尔每升的氯离子,区别就在于生成的沉淀氯化淫是多了还是少了? 比如说浓度为零点零五摩尔每升的氯离子,最终递定终点的时候,生成的绿化也肯定多一些,而零点零四摩尔 本身的绿离子跟银离子反应最终生成的这个绿化因沉淀要稍微少一些,但是沉淀量的多 或者是沉淀量的少,都不会影响他的这个上氢液当中的氯离子的浓度, 因为上新液都是这个沉淀的饱和溶液,一定温度下,饱和溶液当中的离子浓度是一个定制,因此氯离子浓度是不变的,是平移的啊,由 c 点向左平移。 括号四,如果相同条件下,就是说这些数据啊,都不变的情况下,将氯离子改成锈离子,反应终点 c 向哪个方向移动, 还是刚刚所说的啊,反应终点的意思就是两个离子恰好完全反应,那这里就要将氯离子改成负离子了。好, 那将银离子滴入到锈离子的溶液当中,锈离子的浓度等于零点零五,体积也等于刚刚的那个绿离子,那体积五十毫升。那这样滴的话啊,我们就要将绿离子改成锈离子,那么相应的生成的沉淀也要变成锈化银沉淀。 那低定终点仍然是阳离子,和银离子物折量之比为一比一好,那银离子的物折量 等于银离子的浓度零点一乘以体积,我们可以设为 v, 锈离子的物质量等于锈离子的浓度零点零五摩尔,每升乘以五十毫升。好,滴定终点的时候,两者物质量相等,那么就得到零点一 v 等于零点零五乘以五 十毫升,算出来 v 等于二十五毫升。也就是说大家发现了没有,如果将氯离子换成 锈离子之后,滴定终点所用的滴定剂银离子的体积仍然是二十五,仍然是不变的,它的纵坐标会不会发生变化?如果将滤离子改成锈离子的话,那么纵坐标也要由副 log 绿离子改成副 log 锈离子了。 由于绣化银这个沉淀更难融,绿化银这个沉淀相对来说较易融一些。滴定终点的时候, 秀化银的上青叶当中,由沉淀秀化银溶解到溶液里面的锈离子是不是就要少了?因为它难溶,所以说它溶解到溶液里面的离子浓度就小, 锈离子的浓度变小,那么它的负对数就是负 log 锈离子的浓度是不是就要变大? 因为两者成反比的,变大就要变大的话,纵坐标就要往上走,因此反终点由 c 点向 b 点方向移动。大家听明白了吗?
143高中化学大熊🐻❄️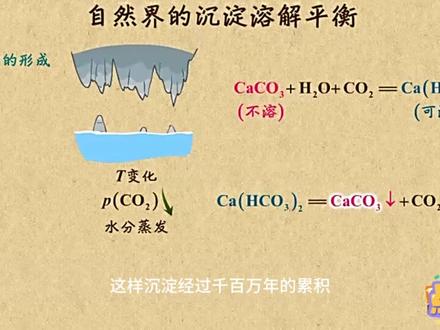 03:29查看AI文稿AI文稿
03:29查看AI文稿AI文稿在自然界中,有很多现象的形成都与沉淀、溶解、平衡有关。下面我就列举几种常见自然现象的形成原因。第一种就是溶洞的形成。 首先,石灰眼里不溶性的碳酸钙遇到水和氧化碳就发生反应,变成了可溶的碳酸氢钙。 接着如有碳酸氢钙的水从溶洞顶向溶洞底部滴落,此时水分蒸发,二氧化碳压强减小,在伴随温度的变化,这些因素都会使碳酸氢钙在分解生成碳酸钙沉淀。 这样沉淀经过千百万年的累积,渐渐的就形成了美丽的石嘴、钟乳石和石柱等等。其整个过程包括了两个步骤,也就是沉淀的溶解和沉淀的生成。第二种是珊瑚的形成。 其实珊瑚是珊瑚虫形成的,这些珊瑚虫是海洋中的一种香肠动物,他们可以从周围的海水中获得钙离子和碳酸氢根离子,经过反应就形成了石灰石的外壳。 另外,珊瑚虫周围藻类植物的生成又会促进碳酸的产生,为啥呢?这是因为他们要进行光合作用,从而将二氧化碳和水转化为葡萄糖和氧气,这样消耗了二氧化碳和水,进而使得平衡正向移动,有利于珊瑚虫形成外壳。 但人口增长、人类大规模感发、森林燃烧酶和其他化石燃料等因素都会干扰珊瑚的生长,甚至造成珊瑚虫的死亡。原因是这些因素都会导致空气中的二氧化碳增多,从而使海水中的二氧化碳浓度也增大,进而使得平衡逆向移动,这样就会把珊瑚虫的外壳融 干,扰了珊瑚虫的生长。刚才两种都是自然界的现象,下面咱再来看两种有关生活的。第一种就是让人讨厌的龋齿,那你知道为啥可以用氟化物来防治他吗? 告诉你,口腔细菌在糖代谢的过程中释放出来的有机酸,穿透牙釉质表面后,使牙齿的矿物质,也就是抢机磷灰时发生溶解,这样健康的牙齿宝宝就变成了龋齿。 另外,由于细菌在牙齿表面还会形成一层粘附膜,叫做齿斑或者菌斑,有了它,这些有机酸就能够长时间的跟牙齿表面密切接触,从而使抢机灵灰石不断溶解。 但饮用水、食物和牙膏中的氟离子会跟抢机磷灰石发生沉淀的转化,生成氟磷灰石。 这个氟利灰石的溶解度比强吉利灰石的溶解度更小,所以它比强吉利灰石更能抵抗酸的侵蚀。除此之外,氟离子还能抑制口腔细菌产酸。看来用氟化物防止龋齿是有化学依据力。 第二种就是水垢中氢氧化镁的形成。咱知道在硬水中含有碳酸氢钙、碳酸氢镁、硫酸镁、硫酸钙、氯化钙、氯化镁等钙镁盐。当煮沸时,硬水中的碳酸氢钙和碳酸氢镁就会发生分解反应,生成碳酸钙和碳酸镁沉淀。 如果持续加热,那生成的碳酸镁在水中又会建立起溶解平衡,其中氢氧化镁的溶解度要小于碳酸镁,因此加热后水垢中的碳酸镁就会转化为溶解度更小的氢氧化镁。所以水垢的最终成分是碳酸钙和氢氧化镁,而没有碳酸镁。 好了,有关自然界和生活中的沉淀溶解平衡,就讲到这,饭饭要去新的地方探险了,你先刷题练练吧。
89H20
猜你喜欢
最新视频
- 4609文老师







